实验原理
双分子荧光互补(Bimolecular fluorescence complementation, BiFC),该技术是利用荧光蛋白的特点来研究蛋白的相互作用。荧光蛋白可从特定的位点被分开,产生两个非荧光活性片段。当两片段分别被融合到相互作用的蛋白上时,会因蛋白的相互作用力而被拉近、发生互补从而重新构建成有活性的荧光蛋白并在激发光下产生荧光。因此利用荧光显微镜就可以直接通过观察荧光有无来判断蛋白是否发生相互作用。
其工作原理如图1所示。
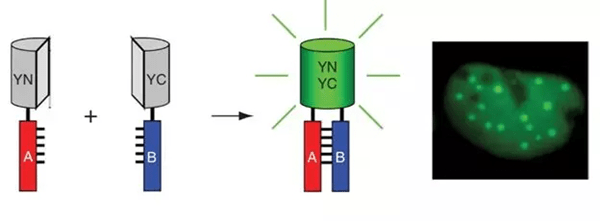
双分子荧光互补-BiFC技术原理
荧光蛋白交叉系统
目前可以用于BiFC技术的荧光蛋白有YFP,GFP,BFP、CFP、Venus和mRFP等,本次介绍YFP和Venus荧光蛋白交叉的系统,即YN155 (YFP的第1-155位氨基酸,其中第YFP的第65位氨基酸由F突变为L,该点突变促进荧光蛋白的成熟)和VC156 (Venus的第156-239位氨基酸)配合使用的系统。该系统降低了假阳性和假阴性线性现象。
载体信息
该系统包含两个载体,即pIB-YN155 (载体示意图,如图2所示)和pIB-VC156 (载体示意图,如图3所示),均由pIB-V5/His载体(载体示意图,如图4所示)改造而来。

图2 pIB-YN155载体示意图
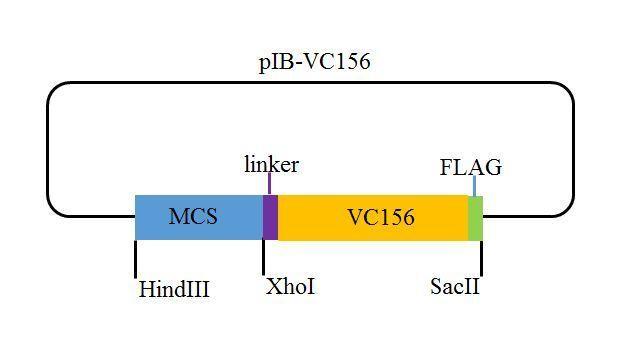
图3 pIB-VC156载体示意图

图4 pIB-V5/His载体示意图
重组载体的构建
仅需要将待筛选的基因克隆到pIB-YN155和pIB-VC156载体上即可。严格意义上,每个基因需要同时构建到上述两个载体上。但是若只构建到一个载体上,就足以检测到互补荧光的产生,则可以不用构建到另一个载体上。
克隆载体时候,要注意使用的酶切位点,确保插入的目基因与后面的YN155或者VC156的ORF对框,确保融合蛋白的正确翻译。
共转染至同一细胞内,用荧光显微镜观察荧光互补结果。
注意:本实验需要设置阴性对照。即用pIB-YN155和pIB-nVC156 (VC156的N端带有atg,可以单独表VC156蛋白)。利用荧光显微镜观察时,需要调节荧光强度,在阴性对照组无荧光信号的情况下,观察实验组的荧光信号。

案例结果展示
BiFC技术优缺点 优点: 1、适用于体内和体外蛋白相互作用的研究 2、在细菌,真菌以及真核细胞中检测时,所研究的蛋白处于天然环境中并且能直观报道蛋白相互作用在细胞中的定位研究 3、BiFC技术耗时较短 4、BiFC只需要荧光倒置显微镜,数据处理简单,只是检测荧光的有无,背景干净,检测更加灵敏,不依赖于其他次级效应 5、BiFC技术还可以用于研究蛋白之间的弱相互作用或瞬间相互作用,不需要蛋白有特别的理论配比,能检测到不同亚群蛋白间的相互作用 缺点: 1、对系统温度敏感,一般在30℃以下形成互补效应好,温度越低,越有利于片段的互补,这对细胞在生理条件下的蛋白相互作用带来不利因素 2、观察到的双分子荧光信号滞后于蛋白的相互作用过程,不能实时观察,蛋白相互作用或蛋白复合物的形成过程 实验思路不迷路,我们拥有专业的技术开发、技术服务团队;具有专业的实验室和一流的设备。拥有分子生物学,免疫学检测,蛋白表达纯化及生物信息学四大平台。为您提供高效、专业服务!BiFC、LCI、亚细胞定位、双荧光素酶检测,可添加Vx(potterlee,沟通详细需求) | 





![]() 万奢网手机版
万奢网手机版

